新聞中心
News Center
捅破肺癌治療天花板!貝莫蘇拜聯合安羅替尼“頭對頭”替雷聯合化療取得顯著優效!
發布時間:2025-04-24
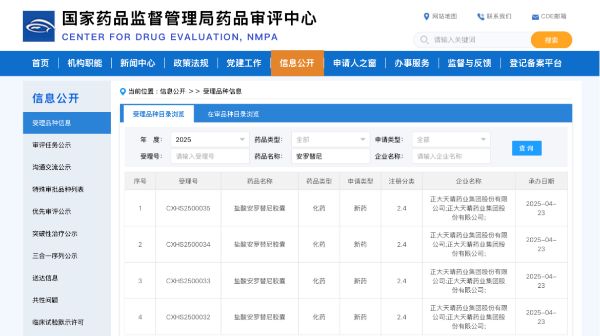
4月23日,中國生物制藥(1177.HK)1類創新藥貝莫蘇拜單抗注射液聯合鹽酸安羅替尼膠囊兩項新適應癥的上市申請獲得國家藥品監督管理局藥品審評中心(CDE)受理:針對晚期鱗狀非小細胞肺癌(sq-NSCLC)患者的一線治療、Ⅲ期非小細胞肺癌(NSCLC)患者的鞏固治療。至此,貝莫蘇拜單抗聯合安羅替尼已經申報上市5個適應癥。
此前,貝莫蘇拜單抗聯合化療后序貫聯合安羅替尼對比替雷利珠單抗注射液聯合化療一線治療晚期sq-NSCLC的主要研究終點無進展生存期(PFS)達到方案預設的優效界值。
頭對頭替雷利珠!一線治療sq-NSCLC取得顯著陽性
TQB2450-Ⅲ-12(NCT05718167)是一項多中心、隨機、雙盲、平行對照的Ⅲ期臨床研究,旨在評估貝莫蘇拜單抗注射液聯合化療后序貫聯合鹽酸安羅替尼膠囊對比替雷利珠單抗注射液聯合化療一線治療晚期鱗狀非小細胞肺癌(sq-NSCLC)的有效性和安全性。
本研究的期中分析結果顯示,與替雷利珠單抗聯合化療組相比,貝莫蘇拜單抗聯合化療后序貫聯合安羅替尼可顯著延長患者的中位無進展生存期(PFS),本研究安全性數據與已知風險相符,未發現新的安全性信號。經獨立數據監查委員會(IDMC)判定,主要研究終點PFS達到方案預設的優效界值。
基于以上試驗結果,公司向CDE提交了貝莫蘇拜單抗及安羅替尼新適應癥的上市申請,并獲得受理。值得關注的是,本研究是全球首個對比PD-1免疫聯合化療一線治療sq-NSCLC取得陽性結果的Ⅲ期臨床研究,詳細研究數據將于2025年美國臨床腫瘤學會(ASCO)上公布。
NSCLC患者鞏固治療新方案獲受理!上市進入倒計時
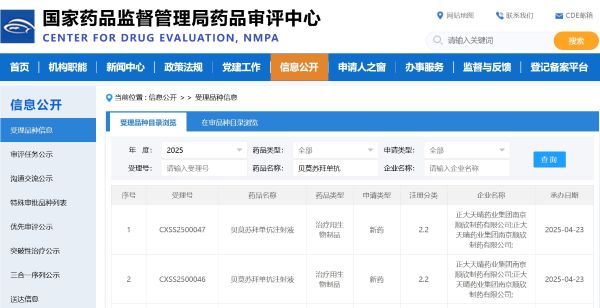
針對局部晚期/不可切除的Ⅲ期NSCLC治療手段有限,同步/序貫放化療后使用免疫單藥鞏固治療是標準治療方案[1,2]。此次同步獲CDE受理的上市申請還有貝莫蘇拜單抗聯合或不聯合安羅替尼,用于同步/序貫放化療后未進展的局部晚期/不可切除(Ⅲ期)NSCLC的鞏固治療。
R-ALPS研究(NCT04325763)是一項隨機、雙盲、平行對照、多中心的Ⅲ期臨床研究,旨在評估該療法的有效性和安全性。研究顯示,相較于對照組,貝莫蘇拜聯合或不聯合安羅替尼治療同步/序貫放化療后未進展的Ⅲ期NSCLC患者可顯著降低疾病進展風險,詳細研究數據將于2025年ASCO公布。
至此,貝莫蘇拜單抗聯合安羅替尼的“免疫+抗血管生成治療”模式已經申報上市5個適應癥,其中用于治療廣泛期小細胞肺癌、子宮內膜癌的適應癥已獲批上市,治療腎細胞癌以及此次獲受理的2個適應癥的上市申請正在審評中。安羅替尼則已經申報上市12個適應癥,其中7個適應癥已獲批上市。
貝莫蘇拜單抗+安羅替尼,持續推進肺癌治療新高度
2022年全球癌癥數據統計顯示,全球肺癌發病人數達248萬,中國發病人數為106.1萬,肺癌在全球和中國的發病率及死亡率居所有惡性腫瘤的第一位[3]。其中非小細胞肺癌(NSCLC)占全部肺癌的80%-85%[4],鱗狀非小細胞肺癌(sq-NSCLC)是NSCLC的主要亞型之一,約占全部NSCLC的30%[5]。雖然免疫聯合化療是多種肺癌的首選方案,但仍有部分患者無法達到腫瘤緩解或在短期內疾病進展,如何擴大免疫治療響應人群,延長無進展生存期是目前亟待解決的問題[6]。
研究發現,免疫治療的響應與腫瘤微環境(TME)的免疫浸潤狀態有關,抗血管生成藥物治療不僅參與微環境中異常血管的重構、調節腫瘤免疫細胞浸潤,還能逆轉TME的免疫抑制狀態[7],二者聯合在抗腫瘤治療中具有協同增效的作用。
貝莫蘇拜單抗作為一種創新人源化抗PD-L1單克隆抗體,能夠精準地作用于腫瘤細胞表面的PD-L1,從而阻止腫瘤細胞對免疫系統的抑制,重新激活免疫細胞。安羅替尼則是一種小分子多靶點酪氨酸激酶抑制劑,能有效抑制VEGFR 1-3、PDGFR α/β、FGFR 1-4、c-Kit等靶點,通過調控腫瘤微環境重編程,起到達到抑制腫瘤血管新生、抑制腫瘤生長、調控免疫微環境的作用。
中國生物制藥1類創新藥貝莫蘇拜單抗聯合安羅替尼的“免疫聯合抗血管生成治療”模式將為肺癌患者提供更多元的治療選擇。隨著多項在研創新項目陸續進入收獲期,“免疫聯合抗血管生成治療”模式必將持續推進肺癌治療的新高度。
參考文獻:
[1] Antonia SJ, Villegas A, Daniel D, et al. Durvalumab after Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. N Engl J Med. 2017;377(20):1919-1929.
[2] Qing Zhou,Ming Chen,et al.Sugemalimab versus placebo after concurrent or sequential chemoradiotherapy in patients with locally advanced, unresectable, stage III non-small-cell lung cancer in China (GEMSTONE-301): interim results of a randomised, double-blind, multicentre, phase 3 trial.The Lancet Oncology.2022;2(23).P209-219.
[3] Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021.
[4] Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: a cancer journal for clinicians, 2024, 74(3): 229-263.
[5] Hirsh V. New developments in the treatment of advanced squamous cell lung cancer: focus on afatinib. Onco Targets Ther. 2017 May 11;10:2513-2526.
[6] Remon J, Passiglia F, Ahn MJ, et al. Immune checkpoint inhibitors in thoracic malignancies: Review of the existing evidence by an IASLC expert panel and recommendations. J Thorac Oncol, 2020,15(6):914-947.
[7] Liang H, Wang M. Prospect of immunotherapy combined with anti-angiogenic agents in patients with advanced non-small cell lung cancer.Cancer Manag Res,2019,11:7707-7719.
▲ 上下滑動查看更多
聲明:
1.新聞稿旨在促進醫藥信息的溝通和交流,僅供醫療衛生專業人士參閱,非廣告用途。
2.本公司不對任何藥品和/或適應癥作推薦。
3.本新聞稿中涉及的信息僅供參考,不能以任何方式取代專業的醫療指導,也不應被視為診療建議。若您想了解具體疾病診療信息,請遵從醫生或其他醫療衛生專業人士的意見或指導。
前瞻性聲明:
本新聞稿中包含若干前瞻性陳述,包括有關【貝莫蘇拜單抗注射液、鹽酸安羅替尼膠囊】的臨床開發計劃、臨床獲益與優勢的預期、商業化展望、患者臨床獲益可能性,以及潛在商業機會等聲明。“預期”、“相信”、“繼續”、“可能”、“估計”、“期望”、“有望”、“打算”、“計劃”、“潛在”、“預測”、“預計”、“應該”、“將”、“擬”、“會”和類似表達旨在識別前瞻性陳述,但并非所有前瞻性陳述都包含這些識別詞。這些前瞻性陳述為公司基于當前所掌握的數據和信息所做的預測或期望,可能因受到政策、研發、市場及監管等不確定因素或風險的影響,而導致實際結果與前瞻性陳述有重大差異。請現有或潛在的投資者審慎考慮可能存在的風險,并不可完全依賴本新聞稿中的前瞻性陳述,該等陳述包含信息僅及于本新聞稿發布當日。除非法律要求,本公司無義務因新信息、未來事件或其他情況而對本新聞稿中任何前瞻性陳述進行更新或修改。